Beide de gemyske ferbinings lykas gemyske eleminten út molekulen besteane, en dizze op har beurt besteane út atomen. De atomen bliuwe ferienige tank oan 'e foarming fan' e saneamde gemyske keppelings.
De gemyske bannen binne net allegear itselde: yn prinsipe binne se ôfhinklik fan 'e elektroanyske skaaimerken fan' e belutsen atomen. D'r binne twa meast foarkommende soarten keppelings: ionyske obligaasjes en de kovalente bannen.
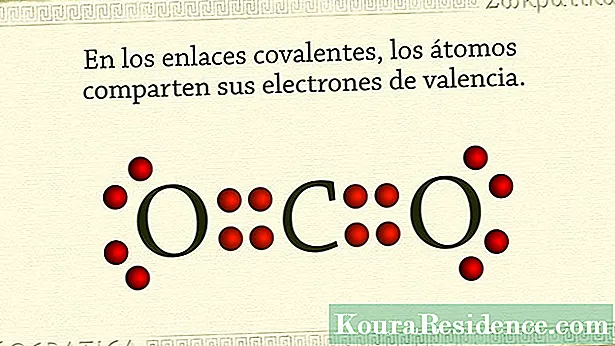
Typysk binne kovalente obligaasjes dyjingen dy't hâld net-metallyske atomen byinoar. It bart dat de atomen fan dizze eleminten in protte elektroanen hawwe yn har bûtenste shell en in oanstriid hawwe om elektroanen te behâlden of te krijen, ynstee fan har op te jaan.
Dêrom is de manier wêrop dizze stoffen as gemyske ferbiningenicos stabiliteit berikke is troch in pear elektroanen te dielen, unet fan elk atoom. Op dizze manier is it dielde pear elektroanen mienskiplik foar de twa atomen en hâldt se tagelyk byinoar. Yn de gassen eallju, bygelyks, dit bart. Ek yn halogen -eleminten.
As de kovalente bining optreedt tusken eleminten fan ferlykbere elektronegativiteit, lykas tusken wetterstof en koalstof, wurdt in bân generearre apolar kovalent. Dit bart bygelyks yn koalwetterstoffen.
Likegoed foarmje homonukleêre molekulen (makke út itselde atoom) altyd apolêre obligaasjes. Mar as de bining optreedt tusken eleminten fan ferskate elektronegativiteit, wurdt in hegere elektronendensiteit produsearre yn ien atoom dan yn in oar, as gefolch dêrfan wurdt in peal foarme.
In tredde mooglikheid is dat twa atomen in pear elektroanen diele, mar dat dizze dielde elektroanen wurde bydroegen troch mar ien atoom derfan. Yn dat gefal sprekke wy fan dative of koördinearje kovalente bân.
Foar in dative keppeling jo hawwe in elemint nedich mei in fergees elektronpaar (lykas stikstof) en in oar dat elektron tekoart is (lykas wetterstof). It is ek needsaaklik dat dejinge mei it elektroanyske pear elektronegatyf genôch is om de elektronen net te ferliezen om te dielen. Dizze situaasje komt bygelyks foar yn ammoniak (NH4+).
De stoffen kovalente ferbiningen befetsje kinne foarkomme yn elke steat fan stof (bêst, floeiber as gaslik), en yn 't algemien se binne minne konduktors fan waarmte en elektrisiteit.
Se litte faak sjen relatyf lege smelt- en siedpunten en binne meast oplosber yn polêre oplosmiddels, lykas benzeen as koalstoftetrachloride, mar hawwe minne oplosberens yn wetter. Se binne ekstreem stabyl.
Tal fan foarbylden fan ferbiningen as stoffen dy't kovalente obligaasjes befetsje kinne wurde jûn:
- Fluor
- Broom
- Iodine
- Chloor
- Soerstof
- Wetter
- Koalstofdiokside
- Ammoniak
- Metaan
- Propaan
- Silica
- Diamant
- Grafyt
- Kwarts
- Glukose
- Paraffine
- Diesel
- Stikstof
- Helium
- Freon


